1. Teori Tumbukan
Menurut teori, sebelum bereaksi partikel-partikel zat pereaksi akan mengalami tumbukan. Tidak semua tumbukan berhasil membentuk zat hasil reaksi. Tumbukan yang baik adalah yang mampu menghasilkan energi. Energi hasil tumbukan itulah yang digunakan untuk merenggangkan atau memutuskan ikatan atom-atom dalam zat pereaksi pada awal proses reaksi kimia. Selanjutnya energi ini disebut energi aktivasi, yaitu energi minimum yang diperlukan oleh zat-zat pereaksi untuk membentuk zat hasil reaksi.
Tumbukan dengan posisi yang benar dan salah dapat ditunjukkan dengan gambar berikut.
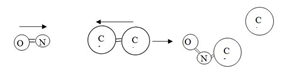
dalam reaksi NO+Cl2 → NOCl+ Cl
2. Teori Keadaan Transisi
Menurut teori ini, sebelum bereaksi zat pereaksi bergerak saling mendekat kemudian berinteraksi membentuk kompleks molekul. Selama berinteraksi terjadi transformasi bentuk dari energi kinetik ke energi potensial. Energi tersebut diserap oleh kompleks molekul untuk membentuk energi potensial tinggi yang mudah bereaksi menghasilkan zat hasil reaksi. Kompleks molekul yang berenergi tinggi dan tidak stabil ini disebut kompleks molekul teraktivasi atau kompleks molekul yang berenergi tinggi.
Berdasarkan teori keadaan transisi, reaksi kimia dapat dilihat sebagai dua tahap. Tahap pertama perubahan pereaksi menjadi keadaan transisi, dan tahap kedua merupakan perubahan keadaan transisi membentuk zat produk. Untuk lebih jelasnya dapat digambarkan sebagai berikut.
Tahap 1. Pembentukan keadaan transisi dari pereaksi
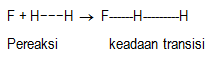
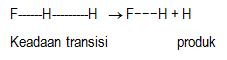
Suatu reaksi kimia akan dapat berlangsung bila antar zat pereaksi saling mendekat dan kemudian melakukan tumbukan. Tumbukan yang menghasilkan reaksi kimia ditentukan oleh:
a. jumlah energi minimumnya (energi aktivasi) dapat terlewati; dan
b. posisi yang tepat dalam melakukan tumbukannya.
Semakin cepat/banyak tumbukan yang terjadi maka reaksi kimia akan cepat berlangsung, dengan kata lain, semakin cepat tumbukan laju reaksi makin cepat pula.
4. Faktor-faktor yang mempengaruhi Jumlah Tumbukan
a. Pengaruh suhu
Bila suhu dinaikkan, energi kinetik zat pereaksi akan meningkat sehingga tumbukan yang terjadi juga akan semakin banyak. Peningkatan suhu ini juga dapat memicu terbentuknya energi yang lebih besar dari energi aktivasi reaksi. Untuk lebih jelasnya dapat dilihat pada gambar berikut kurva fraksi molekul terhadap energi kinetik pada suhu T1 yang lebih kecil dari T2 sebagai berikut:
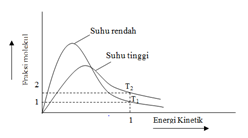
Laju reaksi umumya berubah 2 kali cepat untuk tiap kenaikan suhu 10 .
Pengaruh suhu terhadap laju reaksi dapat dirumuskan sebagai berikut:
Semakin tinggi konsentrasi suatu zat, maka jumlah partikelnya akan semakin banyak, akibatnya jumlah tumbukan persatuan waktu juga akan semakin banyak. Misal dalam suatu ruangan terdapat sejumlah partikel A dan B maka jumlah tumbukan antara partikel A dan partikel B dalam satu satuan waktu adalah satu kali. Jika pada suhu tetap dan jumlah partikel A juga tetap sedangkan jumlah partikel B dibuat menjadi 2x jumlah semula maka jumlah tumbukan persatuan waktu menjadi 2x semula. Jika jumlah partikel A dan B masing-masing diubah menjadi 2x semula maka jumlah tumbukan persatuan waktu menjadi 4x dari semula. Jadi jumlah tumbukan antara partikel A dan B sebanding dengan jumlah partikel A kali jumlah partikel B.
Bila jumlah molekul A dan B dinyatakan dalam bentuk konsentrasinya, maka:
jumlah tumbukan persatuan waktu = [A][B], dimana [A] adalah konsentrasi A dan [B] adalah konsentrasi B.
Bila molekul-molekul yang bertumbukan itu ada tiga jenis, misal A, B dan C, maka:
jumlah tumbukan persatuan waktu = v = k[A][B][C], dimana v = laju tumbukan, k = tetapan laju tumbukan.
c. Pengaruh Luas Permukaan Sentuhan
Bila luas permukaan partikel pereaksi besar, maka bagian yang mampu bertumbukan juga akan semakin luas pula. Hal tersebut tentu saja membuat jumlah tumbukan yang terjadi akan semakin banyak.
d. Pengaruh Katalis
Katalis adalah senyawa pemercepat reaksi yang mampu terbentuk kembali di akhir reaksi. Dengan kata lain, selama mempercepat proses reaksi, katalis tidak ikut bereaksi. Dalam hal ini, katalis berperan menurunkan energi aktivasi. Katalis dapat mengubah langkah-langkah reaksi dari yang berenergi aktivasi tinggi ke energi aktivasi rendah. Bila dalam campuran zat pereaksi diberi katalisator maka jumlah tabrakan antarpartikel pereaksi akan menghasilkan energi yang lebih besar dari energi aktivasi reaksi.
Orde reaksi pada materi Laju reaksi
Orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi.
Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan.
Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan.
Suatu reaksi yang diturunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi :
A + B ----> C
v = k (A) (B) 2
persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat A dan merupakan reaksi orde 2 terhadap zat B. Secara keselurahan reaksi tersebut adalah reaksi orde 3.
Contoh soal:
Dari reaksi 2NO(g) + Br2(g) ® 2NOBr(g)
dibuat percobaan dan diperoleh data sebagai berikut:
Pertanyaan:
a. Tentukan orde reaksinya !
b. Tentukan harga k (tetapan laju reaksi) !
Jawab:
A + B ----> C
v = k (A) (B) 2
persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat A dan merupakan reaksi orde 2 terhadap zat B. Secara keselurahan reaksi tersebut adalah reaksi orde 3.
Contoh soal:
Dari reaksi 2NO(g) + Br2(g) ® 2NOBr(g)
dibuat percobaan dan diperoleh data sebagai berikut:
| No. | (NO) mol/l | (Br2) mol/l | Kecepatan Reaksi mol / 1 / detik |
| 1. | 0.1 | 0.1 | 12 |
| 2. | 0.1 | 0.2 | 24 |
| 3. | 0.1 | 0.3 | 36 |
| 4. | 0.2 | 0.1 | 48 |
| 5. | 0.3 | 0.1 | 108 |
a. Tentukan orde reaksinya !
b. Tentukan harga k (tetapan laju reaksi) !
Jawab:
| a. | Pertama-tama kita misalkan rumus kecepatan reaksinya adalah V = k(NO)x(Br2)y : jadi kita harus mencari nilai x den y. Untuk menentukan nilai x maka kita ambil data dimana konsentrasi terhadap Br2 tidak berubah, yaitu data (1) dan (4). Dari data ini terlihat konsentrasi NO naik 2 kali sedangkan kecepatan reaksinya naik 4 kali maka : 2x = 4 ® x = 2 (reaksi orde 2 terhadap NO) Untuk menentukan nilai y maka kita ambil data dimana konsentrasi terhadap NO tidak berubah yaitu data (1) dan (2). Dari data ini terlihat konsentrasi Br2 naik 2 kali, sedangkan kecepatan reaksinya naik 2 kali, maka : 2y = 2 ® y = 1 (reaksi orde 1 terhadap Br2) Jadi rumus kecepatan reaksinya : V = k(NO)2(Br2) (reaksi orde 3) | ||||
| b. | Untuk menentukan nilai k cukup kita ambil salah satu data percobaan saja misalnya data (1), maka: V = k(NO)2(Br2) 12 = k(0.1)2(0.1) k = 12 x 103 mol-212det-1 Faktor - faktor yang mempengaruhu laju reaksi
Beberapa faktor yang mempengaruhi kecepatan reaksi antara lain konsentrasi, sifat zat yang bereaksi, suhu dan katalisator.
A. KONSENTRASI Dari berbagai percobaan menunjukkan bahwa makin besar konsentrasi zat-zat yang bereaksi makin cepat reaksinya berlangsung. Makin besar konsentrasi makin banyak zat-zat yang bereaksi sehingga makinbesar kemungkinan terjadinya tumbukan dengan demikian makin besar pula kemungkinan terjadinya reaksi. B. SIFAT ZAT YANG BEREAKSI Sifat mudah sukarnya suatu zat bereaksi akan menentukan kecepatan berlangsungnya reaksi. Secara umum dinyatakan bahwa: -Reaksi antara senyawa ion umumnya berlangsung cepat. Hal ini disebabkan oleh adanya gaya tarik menarik antara ion-ion yang muatannya berlawanan. Contoh: Ca2+(aq) + CO32+(aq) ® CaCO3(s) Reaksi ini berlangsung dengan cepat. - Reaksi antara senyawa kovalen umumnya berlangsung lambat. Hal ini disebabkan karena untuk berlangsungnya reaksi tersebut dibutuhkan energi untuk memutuskan ikatan-ikatan kovalen yang terdapat dalam molekul zat yang bereaksi. Contoh: CH4(g) + Cl2(g) ® CH3Cl(g) + HCl(g) Reaksi ini berjalan lambat reaksinya dapat dipercepat apabila diberi energi misalnya cahaya matahari. C. SUHU Pada umumnya reaksi akan berlangsung lebih cepat bila suhu dinaikkan. Dengan menaikkan suhu maka energi kinetik molekul-molekul zat yang bereaksi akan bertambah sehingga akan lebih banyak molekul yang memiliki energi sama atau lebih besar dari Ea. Dengan demikian lebih banyak molekul yang dapat mencapai keadaan transisi atau dengan kata lain kecepatan reaksi menjadi lebih besar. Secara matematis hubungan antara nilai tetapan laju reaksi (k) terhadap suhu dinyatakan oleh formulasi ARRHENIUS: k = A . e-E/RT dimana: k : tetapan laju reaksi A : tetapan Arrhenius yang harganya khas untuk setiap reaksi E : energi pengaktifan R : tetapan gas universal = 0.0821.atm/moloK = 8.314 joule/moloK T : suhu reaksi (oK) D. KATALISATOR Katalisator adalah zat yang ditambahkan ke dalam suatu reaksi dengan maksud memperbesar kecepatan reaksi. Katalis terkadang ikut terlibat dalam reaksi tetapi tidak mengalami perubahan kimiawi yang permanen, dengan kata lain pada akhir reaksi katalis akan dijumpai kembali dalam bentuk dan jumlah yang sama seperti sebelum reaksi. Fungsi katalis adalah memperbesar kecepatan reaksinya (mempercepat reaksi) dengan jalan memperkecil energi pengaktifan suatu reaksi dan dibentuknya tahap-tahap reaksi yang baru. Dengan menurunnya energi pengaktifan maka pada suhu yang sama reaksi dapat berlangsung lebih cepat. E. Pengaruh luas Prmukaan zat Semakin luas permukaan maka laju reaksi akan semakin cepat Bagaimana pengaruh ukuran kepingan zat padat terhadap laju reaksi? Misalkan, kita mengamati reaksi antara batu gamping dengan larutan asam klorida (HCl). Percobaan dilakukan sebanyak dua kali, masing-masing dengan ukuran keping batu gamping yang berbeda, sedangkan faktor-faktor lainnya seperti massa batu gamping, volume larutan HCl, konsentrasi larutan HCl dan suhu dibuat sama. Dengan demikian, perubahan laju reaksi semata-mata sebagai akibat perbedaan ukuran kepingan batu gamping (kepingan halus dan kepingan kasar). Dalam hal ini, ukuran keping batu gamping kita sebut variabel manipulasi, perubahan laju reaksi (waktu reaksi) disebut variabel respon, dan semua faktor lain yang dibuat tetap (sama) disebut variabel kontrol. Mengapa kepingan yang lebih halus bereaksi lebih cepat? Pada campuran pereaksi yang heterogen, reaksi hanya terjadi pada bidang batas campuran yang selanjutnya kita sebut bidang sentuh. Oleh karena itu, makin Kim. 10. Laju Reaksi 28 luas bidang sentuh makin cepat bereaksi. Jadi makin halus ukuran kepingan zat padat makin luas permukaannya. Pengaruh luas permukaan banyak diterapkan dalam industri, yaitu dengan menghaluskan terlebih dahulu bahan yang berupa padatan sebelum direaksikan. Ketika kita makan, sangat dianjurkan untuk mengunyah makanan hingga lembut, agar proses reaksi di dalam lambung berlangsung lebih cepat dan penyerapan sari makanan lebih sempurna. Apa hubungannya dengan tumbukan? Makin luas permukaan gamping, makin luas bidang sentuh dengan asam klorida makin besar, sehingga jumlah tumbukannya juga makin besar. Artinya makin kecil ukuran, makin luas permukaannya, makin banyak tumbukan, makin cepat terjadinya reaksi. Teori Tumbukan pada Laju reaksi
Teori
tumbukan didasarkan atas teori kinetik gas yang mengamati tentang
bagaimana suatu reaksi kimia dapat terjadi. Menurut teori tersebut
kecepatan reaksi antara dua jenis molekul A dan B sama dengan jumiah
tumbukan yang terjadi per satuan waktu antara kedua jenis molekul
tersebut. Jumlah tumbukan yang terjadi persatuan waktu sebanding dengan
konsentrasi A dan konsentrasi B. Jadi makin besar konsentrasi A dan
konsentrasi B akan semakin besar pula jumlah tumbukan yang terjadi.
TEORI TUMBUKAN INI TERNYATA MEMILIKI BEBERAPA KELEMAHAN, ANTARA LAIN :
A + B ® T* --> C + D dimana: - A dan B adalah molekul-molekul pereaksi - T* adalah molekul dalam keadaan transisi - C dan D adalah molekul-molekul hasil reaksi |







Tidak ada komentar:
Posting Komentar